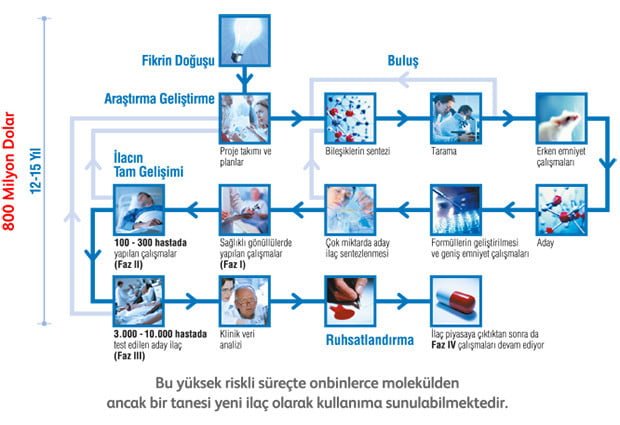
Yeni İlaç Geliştirme Süreci ve Onay Alma Aşamaları
Geliştirilmesi düşünülen ilacın kullanılabileceği hastalıklar ile ilgili yeterli bilgi edinilmesi gereklidir. Bu bilgiler uzun yıllar alan çalışmalar sonucunda elde edilir. Bu çalışmalar sırasında hastalığın etyolojisi, patogenezi, görülme sıklığı, topluma olan ekonomik yükü incelenir.
Bir ilaç fikrinin doğuşundan insanlara ulaşmasına kadar yaşanan süreç:
- Faz 0: Preklinik çalışmalar : Keşif döneminde seçilen kimyasal bileşikler, klinik öncesi faz’a alınırlar. Klinik öncesi faz çalışmalarının amacı potansiyel yeni ilacın etkinlik ve güvenilirliğinin insanlarda denenmeden önce değerlendirilmesidir. Bu çalışmalar hayvanlarda ve laboratuvar modellerinde gerçekleştirilir.
- Faz 1: Çalışmalar az sayıda sağlıklı gönüllülerde yapılır. Amaç; ürünle ilgili doz aralığının saptanması, tolerans ve farmakokinetik özelliklerin incelenmesidir.. Bu çalışmalar ortalama 3- 6 ayda tamamlanır. Bu fazın ana amacı “güvenlilik” verisi elde etmektir. Sadece gelişmiş ülkelerde yapılır.
- Faz 2: İlacın etkinliğinin hastalarda belirlenmesi, yan etki profilinin araştırılması ve doz-cevap verilerinin toplanmasıdır. Çalışmalar az sayıda hasta gönüllülerde yapılır. Bu fazdaki çalışmaların tamamlanması ortalama 2 yılı alır.
- Faz 3: Ürünün klinik etkinliğinin ve yan etkilerinin daha geniş bir hasta popülasyonunda değerlendirilmesidir. Çok sayıda hasta gönüllü bu çalışmalarda yer alır. Klinik çalışmaların bu fazının tamamlanması 3-4 yıl sürer. Bu fazın ana amacı “etkinliğin kanıtlanması ve yan etkilerin izlenmesidir. Bu çalışmalarda yeterli veriler elde edildikten sonra ilaçlar ruhsat alıp piyasaya verilebilir.
- Faz 4: Ürün ilaç olarak kullanılmaya başlandıktan sonra yapılan klinik çalışmalardır. Bunlara genel olarak “postmarketing surveillance” (pazarlama sonrası izleme) çalışmaları adı verilir. Genellikle binlerce gönüllü ile gerçekleştirilir ve uzun yıllar sürebilir. Bu çalışmaların ana amacı “uzun süreli güvenlilik” verilerinin toplanmasıdır. Klinik çalışmalar sırasında ortaya çıkmayan ender yan etkiler bu araştırmalar sırasında rapor edilebilir. Yeni tedavi endikasyonları için ipuçları sağlanır.
İlaç geliştirme süreci ilacın patent ömrü boyunca sürer.
Bir ilacın klinik aşamalara geçebilmesi için Investigational New Drug (IND) numarası alması gerekmektedir. Tüm bu aşamalar yaklaşık 15-20 yıl arası sürüyor. Toplam harcamalar ise yaklaşık 1 milyar dolar tutuyor.